負極:Pb+SO42-→PbSO4+2e-・・・①
正極:PbO2+SO42-+4H++2e-→PbSO4+2H2O・・・②
S=32,O=16,H=1
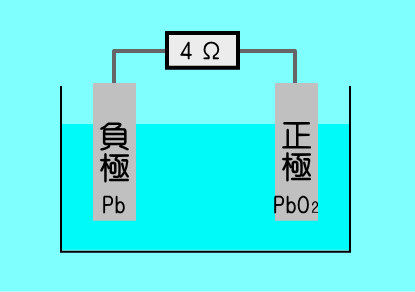
4Ωの抵抗とつなげて回路を作った.
この状態で1時間4分20秒,放電した.
鉛蓄電池の電圧は2.0V,電流はオームの法則より
|
V |
|
.0 |
|
| I= |
——— |
= |
——————— |
=.0(A)=.0(C/s) |
|
R |
|
.0 |
|
放電した電気量は
I(C/s)×(1×+4×+20)(s)=
.0×=1930(C)
電子e-1molのもつ電気量は00(C)
これで割ると
| 1930 |
|
|
|
| —————————————— |
= |
—————————— |
|
| 00 |
|
|
|
=0.0(mol)
これが流れた電子の量である.
負極の反応式①より係数の比を見ると
Pb : e-= :
|
|
|
|
| だから,Pbは0.0× |
————— |
|
|
|
|
|
|
=0.0mol反応した.
SO42-も0.0mol,負極に結合したことになるので,
SO42-=32+16×=(g/mol)
×0.0=.(g)
.g,負極は質量がしたことになる.
正極は反応式②より
PbO2 ; e-= :
よってPbO2も
|
|
|
| 0.020× |
————— |
=0.0mol反応した. |
|
|
|
正極の場合,PbSO4-PbO2=SO2分,質量が増加する.
SO2=32+16×=(g/mol)
×0.0=0.(g)
0.g,正極は質量がしたことになる.
SO42-も負極,正極でそれぞれ0.0molずつ消費されるので
合計0.0molしたことになる.
