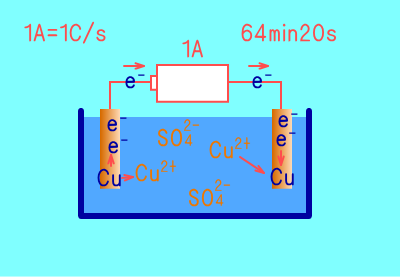
マンガン電池を使って電気分解する.
電流は1Aとする.
電気分解の装置は,電極が陽極,陰極ともに銅電極で,
水溶液は硫酸銅水溶液とする.
この装置で64分20秒電流を流したところ,陰極では銅が析出して重くなり,
陽極では銅が溶出して軽くなった.
陽極:Cu→Cu2++2e-
陰極:Cu2++2e-→Cu
陽極も陰極もどちらも電子e-個に対して銅Cu1個が溶出したり析出したりしている.
64分×+20=3600+240+20=秒
×A=C
| C |
|
|
|
|
|
| ————————————————— |
|
|
|
|
|
| 00C/mol |
|
|
|
|
|
=.×10-2mol・・・流れた電子e-のモル数
銅Cuは.×10-2÷=.×10-2mol
反応したことになる.
Cu=64g/molとすると
|
|
|
|
|
|
| 64× |
———— |
= |
——————————— |
≒ |
.g |
|
100 |
|
100 |
|
|
≒:ニヤリーイコールと呼ぶ.ほとんど同じの意味.(nearly equal)
つまり,陽極では,.g,
陰極では.gしたことになる.
